Le radiazioni nucleari: cosa sono? Da dove vengono? Cosa le rende così pericolose?
Ancora una volta le radiazioni nucleari fanno parlare di sé e spaventano il mondo. In quest’articolo si proverà a fare chiarezza sull’argomento, provando a rispondere ad alcune domande.
Che cosa sono le radiazioni? E cosa le produce?
Perché sono così temute e quali sono gli effetti nocivi che esercitano a livello cellulare?
“Nucleare: dall’atomo alla PET”
N. 1
Questo è il primo numero della Rubrica di Area dal titolo “Nucleare: dall’atomo alla PET”, appartenente alla Macroarea di Scienze
L’atomo: le fondamenta della sua struttura
Per parlare di radiazioni non possiamo non menzionare brevemente l’atomo e la sua struttura. Nel 1803, il fisico inglese John Dalton ipotizzò che gli elementi chimici fossero composti da un insieme di atomi dello stesso tipo. Nel corso della storia si misero a punto innumerevoli modelli per descrivere la struttura atomica, che hanno accompagnato le interminabili ore di scienze di molti studenti liceali. Ma vale la pena soffermarsi su uno dei più interessanti e dei più vicini alla realtà. Giova sempre ricordare, infatti, che la scienza approssima la realtà e tende ad essa senza mai raggiungerla pienamente.
Il modello cui facciamo riferimento è quello di Bohr-Sommerfeld che pone al centro dell’atomo un nucleo, costituito da un numero variabile di neutroni (a carica neutra) e protoni (carichi positivamente) attorno cui gravitano degli elettroni (carichi negativamente) lungo orbitali energetici prefissati. Gli elettroni orbitano attorno al nucleo secondo una traiettoria circolare, in virtù della forza di attrazione elettrostatica.
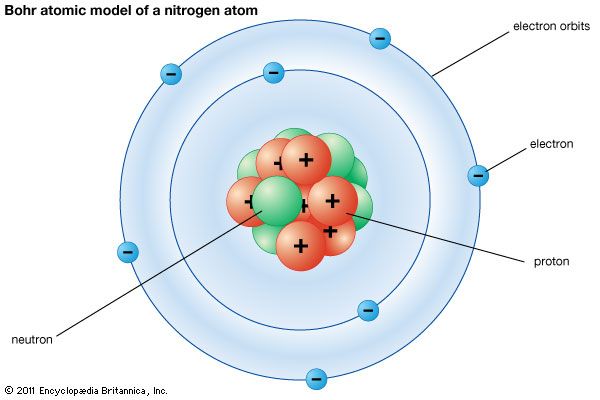
Prendiamo come esempio l’atomo più semplice esistente in natura: l’idrogeno (H), formato da un solo protone e un elettrone. Per essere precisi, quello che abbiamo descritto è il prozio, cioè un isotopo dell’idrogeno. Ciò che differenzia un atomo da un altro è il numero dei protoni nel nucleo, ma ciò che distingue gli isotopi di un elemento è il numero dei neutroni.
L’atomo di idrogeno, nel nostro esempio, ha tre isotopi: il prozio che ha zero neutroni, il deuterio che ha un neutrone, e il trizio che ne ha due. Conoscere l’esistenza degli isotopi è fondamentale per comprendere la radioattività e l’instabilità di alcuni elementi, sfruttata per ricavare una quantità enorme di energia.
I neutroni assolvono un ruolo fondamentale all’interno del nucleo, perché separano tra loro i protoni che, essendo tutti carichi positivamente (+1), tenderebbero a respingersi e a far disgregare il nucleo atomico.
Le forze dentro un nucleo
La stabilità di un nucleo atomico è data dalla sommatoria delle forze che interagiscono tra le particelle subatomiche. Essendo le particelle dotate di massa, esse esercitano vicendevolmente una forza gravitazionale che può essere descritta dalla legge di gravitazione Universale di Newton:
Fg = G (M x m)/r2
dove
Fg è la forza gravitazionale
G è la costante di gravitazione Universale
M e m sono le masse delle due particelle prese in considerazione;
r2 è il quadrato della distanza che le separa;
La forza di attrazione gravitazionale tra due protoni a una distanza pari a 10^-20 metri risulta essere pari a 10^-24 newton.
Due protoni, oltre ad essere dotati di massa, sono provvisti di una carica elettrica positiva; quindi, tenderanno a respingersi con una forza elettrostatica repulsiva descritta dalla legge di Coulomb:
Fe = K (Q1 Q2)/r2
dove
Fe è la forza elettrostatica;
K è la costante di Coulomb;
Q1 e Q2 sono le cariche elettriche dei due protoni, uguali tra loro e pari a +1;
r^2 è il quadrato della distanza che separa i due protoni nel nucleo di un atomo;
La forza di Coulomb tra due protoni, di direzione uguale e verso opposto rispetto alla forza di attrazione gravitazionale, è pari a 10^12 Newton.
Se fossero solo queste le forze in gioco, nessun atomo potrebbe essere stabile: tutti tenderebbero a disgregarsi, liberando radiazioni. Perché questo non accada deve intervenire un altro tipo di forza attrattiva che agisce a corto raggio, definita forza nucleare.
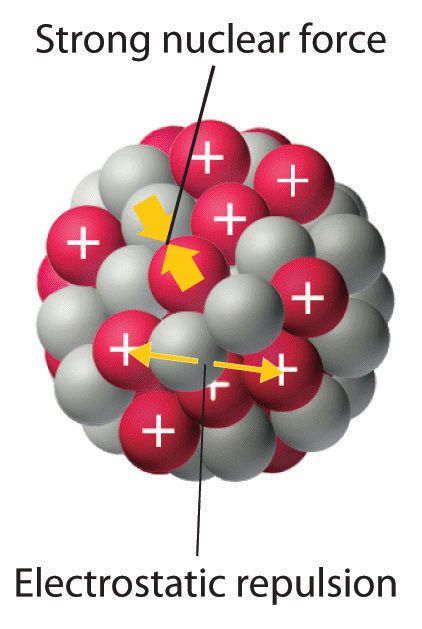
Potremmo immaginare che all’interno del nucleo atomico si stia disputando un perenne tiro alla fune in cui, la squadra delle forze gravitazionale e nucleare si oppone alla squadra della forza elettrostatica, permettendo alla bandierina – il protone in questo caso – di oscillare minimamente sulla sua posizione senza spostarsi in modo evidente, perché le due fazioni sono ben bilanciate.
I nuclei instabili: una fonte naturale di radiazioni
Alcuni nuclei, dotati di un numero di massa elevato, possono presentare un esubero o una carenza di neutroni che potrebbero inficiare la loro stabilità. Questi atomi tendono a decadere, cioè a trasformarsi in atomi di altri elementi, solitamente più leggeri, perdendo particelle subatomiche, sottoforma di radiazioni α e β, e/o energia, sottoforma di radiazioni elettromagnetiche ad alta frequenza. Tutti i nuclidi con numero atomico maggiore di 82 sono instabili e quindi soggetti a decadimento radioattivo.
Nel 1896 Bequerel scoprì che sali di Uranio potevano impressionare le lastre fotografiche, come i raggi X scoperti poco prima da Roentgen; i coniugi Curie scoprirono due elementi ancora più radioattivi: polonio e radio; mentre Rutherford caratterizzò le tre principali forme di radioattività: radiazioni α, β e γ.
Le radiazioni scoperte da Rutherford possono essere classificate in corpuscolate (α e β) che trasportano energia insieme a cariche elettriche e materia; e in elettromagnetiche o fotoniche che propagano solo energia secondo un movimento ondulatorio (raggi γ, raggi X etc.).
Intuitivamente possiamo paragonare un’onda elettromagnetica a un’onda marina: la sua propagazione sulla superficie dell’acqua determina uno spostamento di energia, ma la materia che si trova sul suo cammino, come una boa galleggiante, non ne segue la direzione, limitandosi ad oscillare in alto e in basso. Similmente l’onda elettromagnetica è il risultato di un’oscillazione, ma anziché di una boa, di due campi: il campo elettrico e magnetico che agiscono su piani perpendicolari tra loro. Tale radiazione ondulatoria si propaga in linea retta e alla velocità della luce nel vuoto che è pari a una costante, insuperabile da qualsiasi altra forma di energia o materia: 299 792 458 m / s.
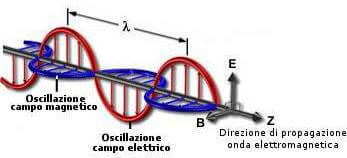
Come tutte le onde, anche quelle elettromagnetiche hanno una lunghezza d’onda λ e una frequenza f. La quantità di energia contenuta in un’onda è direttamente proporzionale alla frequenza.
Diverse forme di radiazioni
La radiazione α è costituita da un atomo di elio, formato da due protoni. Viene liberata da un elemento più pesante che si trasformerà nell’atomo con numero atomico diminuito di due unità. Questo tipo di radiazione ha una bassa capacità di penetrare i corpi, può, infatti, venire bloccata dallo strato di cellule morte – o per meglio dire cheratinizzate – dell’epidermide.
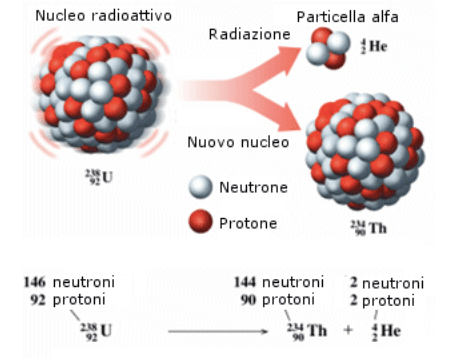
La radiazione β^-, invece, viene prodotta quando, in un atomo con un numero atomico Z, un neutrone si converte in un protone, producendo contestualmente un elettrone e un antineutrino. L’atomo di partenza si convertirà nell’atomo dell’elemento successivo della tavola periodica, con numero atomico pari a Z+1. Un antineutrino è una particella subatomica di antimateria, capace di liberare un’enorme quantità di energia sotto forma di radiazioni elettromagnetiche.
La radiazione β^+ viene prodotta, invece, quando in un atomo un protone diventa un neutrone e vengono prodotti un positrone e un neutrino. L’atomo da cui la radiazione ha avuto origine si trasformerà in un elemento con numero atomico diminuito di una unità.
I raggi β vengono bloccati da una pellicola di alluminio di 1 mm di spessore.
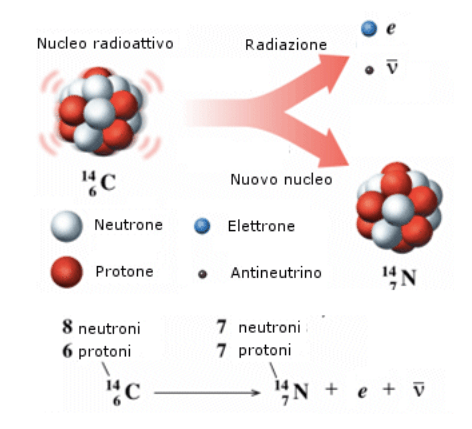
I raggi γ sono radiazioni elettromagnetiche ad altissima frequenza estremamente penetranti che possono essere bloccate da una lastra di piombo di 2.5 o 5 cm di spessore! Queste radiazioni sono le più pericolose, subito seguite dai raggi X e dai raggi cosmici provenienti dallo spazio, perché sono in grado di trasformare gli atomi in ioni e per questo vengono dette ionizzanti.
Le onde elettromagnetiche di energia sufficientemente alta riescono a eccitare un elettrone abbastanza da farlo sfuggire all’attrazione elettrostatica esercitata dal nucleo. Il raggio γ costituisce una sorta di forza propulsiva che permette all’elettrone di spiccare il volo, come i motori di uno Space Shuttle permettono al razzo di vincere l’attrazione gravitazionale terrestre per raggiungere lo spazio vuoto.
Inserire immagine energia di ionizzazione: fonte shutterstoke
Come le radiazioni interferiscono con la materia?
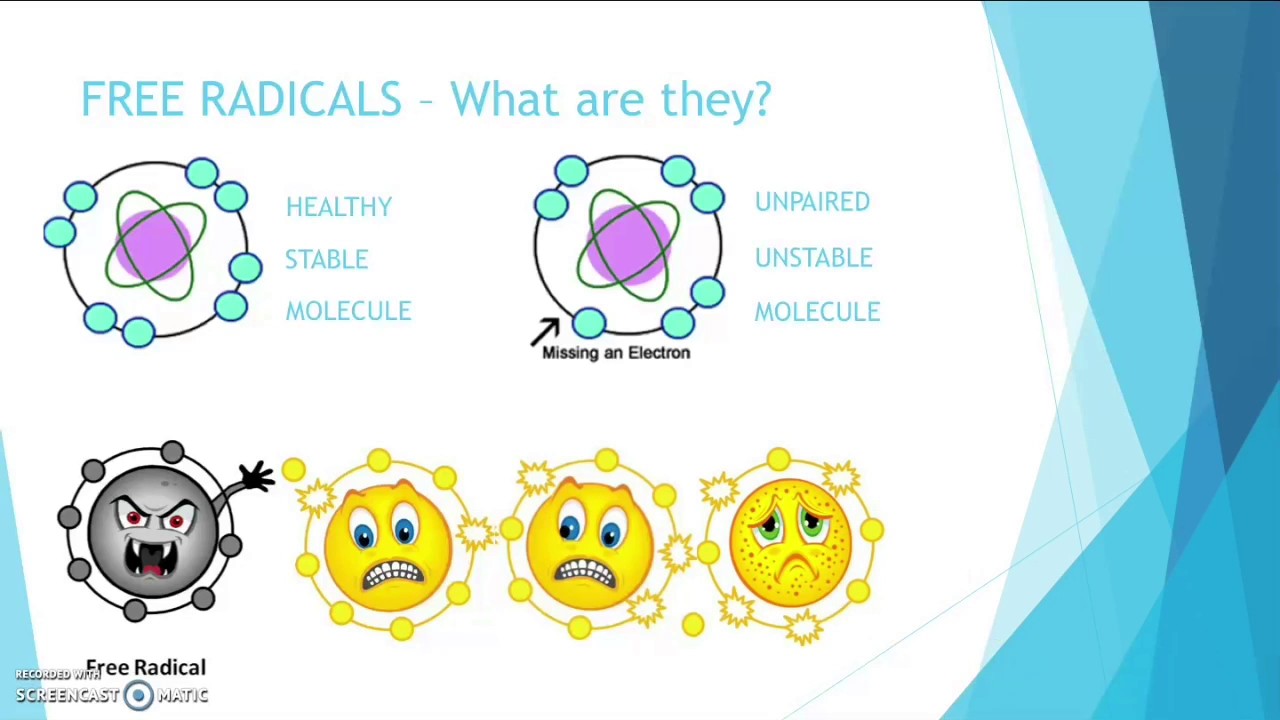
Uno dei modi in cui le radiazioni possono interferire con la struttura della materia è proprio il processo di ionizzazione. Le molecole biologiche (come il DNA, le proteine, gli zuccheri e i grassi) che costituiscono le unità strutturali indispensabili per una cellula, sono derivate dall’unione, per mezzo di legami chimici, di atomi. La ionizzazione di un atomo, cioè la perdita della sua neutralità elettrostatica, determina un irrimediabile compromissione della stabilità della molecola cui appartiene.
Le molecole così destabilizzate vengono dette radicali liberi, noti al grande pubblico per una teoria sull’invecchiamento che li vede come principali responsabili della senescenza cellulare. Per definizione, queste specie chimiche sono caratterizzate dalla presenza di un elettrone singolo, quando la loro forma più stabile, cioè meno reattiva (che tende a fare meno reazioni), prevederebbe elettroni raggruppati in coppie.
I radicali liberi tendono ad attaccare altre molecole limitrofe che si trovano in una configurazione stabile, strappando loro un elettrone. In questo modo viene ripristinata la configurazione elettronica, il doppietto, nel radicale libero di partenza, destabilizzando però la specie chimica “derubata”. Si inizia, così, una reazione a catena che si interrompe solo quando due radicali liberi si incontrando e si legano a formare una molecola più grande e stabile.
Se la molecola colpita da un radicale libero fosse il DNA le conseguenze per la cellula potrebbero essere molto gravi. Il DNA, infatti, contenuto nel nucleo di tutte le cellule somatiche del nostro organismo, è la molecola depositaria dell’informazione genica, cioè di tutte le istruzioni necessarie alla cellula per svolgere tutte le sue funzioni. Un grave danno al DNA potrebbe, nella migliore delle ipotesi, causare delle mutazioni che, negli anni, potrebbero portare a una trasformazione in senso tumorale del clone cellulare colpito dal danno; ma, nella peggiore delle ipotesi, potrebbe anche portare la cellula a morte.
Conclusioni
In questo articolo abbiamo parlato della natura fisica delle radiazioni, partendo dal principio, l’atomo, per tentare di comprenderne le componenti, le forze che ne preservano la stabilità e, in ultimo, ciò che lo porta a decadere liberando grandi quantità di energia. Nel prossimo articolo approfondiremo gli effetti delle radiazioni sulle cellule e, più in generale, sulla salute umana, cercando di fare chiarezza sulle potenzialità mutagene e sulla temibile sindrome acuta da radiazioni.
Francesco Lodoli per Questione Civile
Bibliografia
Binaglia L., Giardina B., Ed. III 2015, Chimica e Propedeutica biochimica, Milano, Mc Graw Hill Education; capp. 1 e 2;
Kumar V., Abbas A.K., Aster J.C. Robbins e Contran Ed. IX 2015, Le basi patologiche delle malattie Patologia generale, Vol. 1, Edra, cap. 9.


